Nueva arma contro Bebes y Niños
No pierden el tiempo
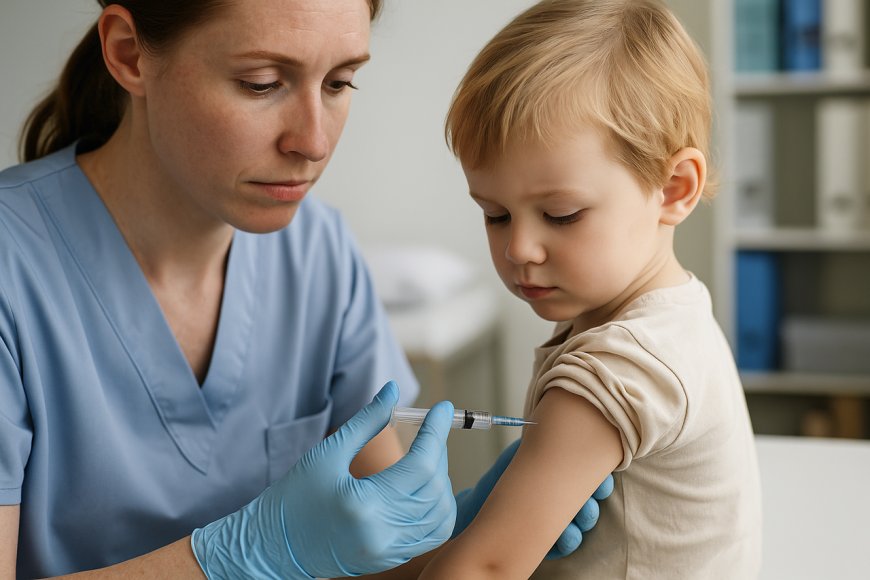
La Administración de Alimentos y Medicamentos de EE. UU. (FDA) ha otorgado la aprobación completa a la vacuna Spikevax de Moderna para niños de entre 6 meses y 11 años que presenten condiciones médicas que los colocan en alto riesgo de COVID‑19 . Hasta ahora, esta población solo tenía acceso a la vacuna bajo autorización de emergencia (EUA), lo que marca un avance significativo en la protección pediátrica.
Cobertura extendida por una revisión rigurosa
Moderna presentó una Suplemental Biologics License Application (sBLA) al incorporar datos específicos de eficacia y seguridad en menores. El estudio KidCOVE, centrado en menores de 6 meses a 5 años, mostró una respuesta inmune no inferior a la de adultos, con un perfil de efectos secundarios leve. Con esta aprobación, Slidevax también alcanza al grupo de 6 meses a 64 años con factores de riesgo, aportando una capa adicional de protección en la nueva temporada respiratoria 2025-2026
Nueva etapa para la vacunación infantil
La FDA ha decidido que esta vacuna ya no sea una alternativa temporal, sino una solución estándar para niños vulnerables. Fernández, principal epidemióloga del HHS, enfatizó que esta medida brinda “certeza y continuidad para padres y profesionales de la salud”, reduciendo la carga de procedimientos regulatorios.
El CDC, por su parte, se mantiene neutral: recomienda Spikevax en población sana solo bajo asesoramiento médico , reflejando un enfoque cauteloso que contrasta con su respaldo total a los grupos de riesgo.
Contexto y comparación actual
La aprobación completa de Spikevax pone a EE. UU. a la vanguardia global, al ampliar el espectro de protección hasta los 6 meses de edad. En 2022, la FDA había aprobado Spikevax para adultos y, en mayo de 2025, autorizó también un nuevo formato, el mNEXSPIKE, para adultos de alto riesgo .
La nueva aprobación llega en un contexto marcado por la amenaza constante del COVID‑19 —todavía asociado con hospitalizaciones y complicaciones y al inicio de una temporada respiratoria crítica. Moderna espera distribuir las dosis a tiempo para el otoño .
Beneficios y expectativas
Los clínicos destacan que la aprobación plena mejora la confianza, facilita la logística de programas de vacunación y reduce la incertidumbre de escasez regulatoria. El CEO de Moderna, Stéphane Bancel, afirmó que ahora se puede proteger a “los más jóvenes... contra enfermedades graves y hospitalización”
???? En resumen
Spikevax ya cuenta con aprobación total para niños de 6 meses a 11 años en riesgo.
La decisión se basa en evidencia robusta de inmunogenicidad y seguridad pediátrica.
Moderna planea lanzar el producto para la temporada respiratoria 2025‑2026.
Se consolida la estrategia nacional de vacunación preventiva frente a nuevas variantes y brotes.
Este es un paso crucial para la salud pública infantil, reduciendo brechas en la protección y asentando un camino hacia una mayor resiliencia comunitaria.
Fuente: Noticia al dia
¿Cuál es tu reacción?